來源:本文刊登于《中國醫療器械信息》雜志2022年第28卷第19期
內容提要:美國FDA醫療器械審查標準轉化是國內醫療器械注冊技術審查指導原則的重要編制方式。文章以《類風濕因子檢測試劑注冊技術審查指導原則》為例介紹美國FDA醫療器械審查標準轉化工作和轉化成果情況,建議我國開展美國FDA醫療器械審查標準轉化基于國內產品和監管實際情況,建立轉化工作的指導和規范性文件,完善轉化成果的修訂和完善機制。
? ? ? 醫療器械技術審查指導原則的編制工作由國家藥品監督管理局醫療器械技術審評中心組織開展,目前已建立了包括約500 項指導原則的文本庫,以供開放下載和使用[1]。文本庫內容包含有源醫療器械、無源醫療器械、體外診斷試劑類醫療器械技術審查指導原則和通用指導原則。其中有相當比例的指導原則編制工作是以美國食品藥品管理局(Food and Drug Administration,FDA)醫療器械審查標準轉化的方式進行的,如《家用體外診斷醫療器械注冊技術審查指導原則》、《抗核抗體檢測試劑注冊技術審查指導原則》、《類風濕因子檢測試劑注冊技術審查指導原則》等。文章以《類風濕因子檢測試劑注冊技術審查指導原則》的編制工作為例,介紹我國開展美國FDA 醫療器械審查標準轉化工作的基本情況,并對轉化成果的應用及后續轉化工作的開展提出建議。
1.概述
我國醫療器械產品注冊相關法規體系構架的構成由上至下依次為行政法規、部門規章、規范性文件、技術指導原則和技術標準等。按照《體外診斷試劑注冊與備案管理辦法》[2](國家市場監督管理總局令第48 號)的要求,體外診斷試劑注冊、備案應當遵守相關法律、法規、規章、強制性標準,遵循體外診斷試劑安全和性能基本原則,參照相關技術指導原則,證明注冊、備案的體外診斷試劑安全、有效、質量可控,保證信息真實、準確、完整和可追溯,這為指導原則的應用確定了法規依據。
對各國醫療器械監管機構的政策法規對比研究是我國醫療器械監管科學研究的重要工作內容之一。截至2015 年,美國FDA發布的醫療器械審查標準已有700 多項,包括產品類和通用類的審查標準,覆蓋面極其廣泛[3,4]。選擇其中重要的和我國醫療器械技術指導原則體系構建急需的審查標準進行合理轉化,可以迅速為我國醫療器械監管工作補充技術性參考文件,為醫療器械技術審評提供審查依據,同時指導相應產品注冊申請人的產品研發及注冊申報資料的準備及撰寫工作。2019年度第二類醫療器械注冊技術審查指導原則編寫計劃中,共有30 個指導原則編制項目立項,其中6 項為美國FDA審查標準轉化項目,占比達到20%。在監管對象層面,醫療器械研發團隊及生產企業充分研究醫療器械相關國際政策法規及技術規范是全球化發展對其提出的必然要求。
2.《類風濕因子檢測試劑注冊技術審查指導原則》轉化實例分析?
2.1 背景及目的
伴隨著環境的惡化和人口老齡化的趨勢越來越嚴重,老年性疾病的發病率也逐年升高,類風濕性疾病的患者也越來越多。類風濕因子最初在類風濕關節炎血清中發現,后發現其在其他自身免疫性疾病及感染、淋巴細胞增生性疾病中能檢測到[5,6]。類風濕因子的檢測結果為臨床醫生的診斷和治療提供著重要數據支持,同時,研究發現類風濕因子也是很多其他臨床檢測項目的內源性干擾物[7-10]。據統計,國內外關于類風濕因子檢測情況的文獻報道屢見不鮮,但目前我國尚且沒有類風濕因子檢測相關的技術文件對商品化的類風濕因子檢測試劑產品進行規范和指導,國內各審評機構對該類產品的注冊技術審評工作缺少統一尺度,這不利于行業內該類產品的整體質量控制,也不利于醫療機構檢查檢驗結果互認工作的推進。為解決上述問題,課題組立項編制類風濕因子檢測試劑注冊技術審查指導原則,采用美國FDA 體外診斷器械審查標準轉化的工作方式。
2.2 方法和過程
《類風濕因子測定試劑注冊技術審查指導原則》轉化工作自2019 年2 月啟動到2020 年12 月發布實施,歷時兩年,工作內容及階段性成果見表1。轉化的主要研究依據包括美國FDA 醫療器械審查標準《Review Criteria for Assessment of Rheumatoid Factor (RF) in vitro Diagnostic Devices Using Enzyme-Linked Immunoassay (EIA), Enzyme Linked Immunosorbent Assay (ELISA), Particle Agglutination Tests, and Laser and Rate Nephelometry》(中文名稱《使用酶聯免疫測定(EIA)、酶聯免疫吸附測定(ELISA)、顆粒凝集試驗以及激光和速率比濁法評估類風濕因子(RF)體外診斷器械的審查標準》,以下簡稱“美國FDA審查標準”)、我國醫療器械注冊法規、規范性文件和國內已上市類風濕因子檢測試劑產品情況等,主要研究方法有文獻檢索、生產企業現場調研、問卷調研、數據研究、專題研討會、研討會、公開征求意見等。
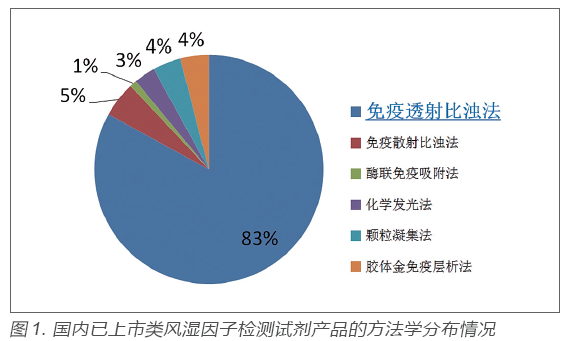
類風濕因子臨床檢驗及臨床應用情況調研結果顯示,當前臨床實驗室檢測類風濕因子最常用方法為(乳膠增強)免疫比濁法,包括免疫透射比濁法和免疫散射比濁法。
2.3.2 產品技術要求中性能指標及檢驗方法
目前國內尚且沒有針對類風濕因子檢測試劑產品專門的國家標準和行業標準。現場調研及問卷調研結果顯示,已上市類風濕因子檢測試劑產品的性能指標確定大多依據YY/T 1255-2015《免疫比濁法檢測試劑(盒)(透射法)》。行業標準YY/T 1549-2017《生化分析儀用校準物》、YY/T 1662-2019《生化分析儀用質控物》、YY/T 1652-2019《體外診斷試劑用質控物通用技術要求》自發布實施以來,各省在產品注冊過程中開始建議企業執行該推薦性行業標準,生產企業也逐步開始按照行業標準的要求進行性能研究和指標確定。因此,指導原則中提示了制造商可以參考執行標準YY/T 1255-2015、YY/T 1549-2017、YY/T 1662-2019、YY/T 1652-2019等相關標準的要求制定產品技術要求。
2.3.3 產品說明書中重點提示的內容
課題組根據調研及臨床專題研討會獲得的類風濕因子檢測試劑產品研發和臨床使用過程中的關注內容,明確了說明書中類風濕因子檢測試劑的適用范圍、干擾、參考區間等重點關注內容。
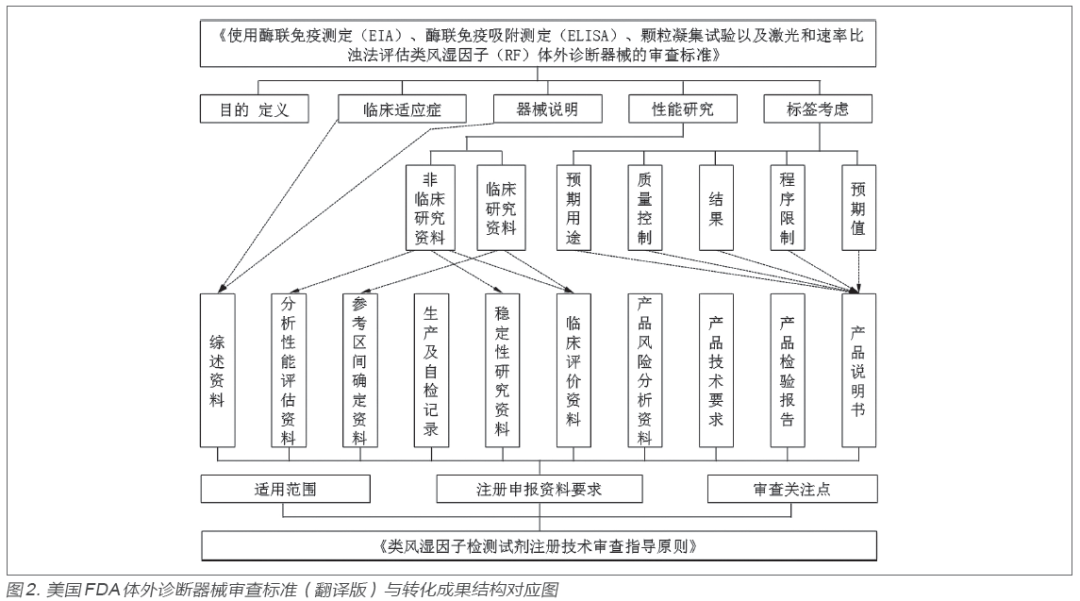
2.4 轉化成果與美國FDA審查標準對比分析
經過歷時兩年的美國FDA審查標準轉化,最終形成轉化成果即《類風濕因子檢測試劑注冊技術審查指導原則》。該指導原則于2020 年12 月由國家藥品監督管理局網站公開發布實施[11]。指導原則內容主要包括適用范圍、注冊申報資料要求、審查關注點等三部分,如圖2 所示。