醫療器械創新網

11月23日,國家藥品監督管理局就《醫療器械不良事件監測和再評價管理辦法(修正案草案)》(以下簡稱《辦法》)公開征求意見。
醫療器械不良事件監測是實施醫療器械上市后監管的重要工作內容,是強化醫療器械全生命周期監管、實現科學監管、提高監管成效的重要舉措。
2021年6月1日,新修訂版《醫療器械監督管理條例》正式施行。《條例》結合監管實際,提出醫療器械“注冊人、備案人”概念,對應上市許可持有人概念。現國家藥監局結合《條例》的修訂內容,對《醫療器械不良事件監測和再評價管理辦法》進行了局部修改,主要涉及全面實施醫療器械注冊人制度,修改相關名詞表述,調整個別監管措施,修改相關罰則表述。
醫療器械不良事件是指已上市的醫療器械,在正常使用情況下發生的、導致或者可能導致人體傷害的各種有害事件。報告醫療器械不良事件應當遵循可疑即報的原則,即懷疑某事件為醫療器械不良事件時,均可以作為醫療器械不良事件進行報告。
近年來,醫療器械不良事件時有發生。2020年,國家醫療器械不良事件監測信息系統收到醫療器械不良事件報告536,055份,比上年增加35.25%。

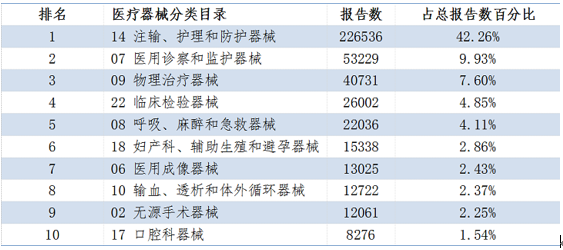
2020年醫療器械不良事件報告涉及醫療器械分類目錄情況,圖源:國家藥監局
近年來,我國對醫療器械上市后監管及臨床使用安全越加重視,醫療器械不良事件監測和再評價作為醫療器械上市后監管體系中的重要環節也將面臨更加嚴苛的監管。對于醫療器械的各個參與方亦應該及時了解、遵循相關法律法規。